 左半分が変色したスチロールケース
左半分が変色したスチロールケース植物と菌根菌だけの系での接種、菌根合成について。「無菌系」と言うこともありますが、菌根「菌」はいるのですから、その言い方はちょっと変ですね。
# こーゆー実験の方法について、M大学のM先生に森林学会で何度も「前世紀的」っていわれちゃった、しゅーん。とか言ってみる。
普通は純粋培養した菌糸体を使います。時には汚染のないよう注意して得た胞子を用いる場合もあります。胞子紋をとるようにして直接無菌の根に胞子を落としてやることも。あまり胞子が飛ばないからとしばらく置いておいたらキノコバエの幼虫が培地を這ってたなんてこともありました。案外コンタミしないんですよね、それでも。まあ気持ち悪いのでそういうのは使いませんが。
分離や培養については別項に書きましたが、そのようにして得た菌株の旺盛に生育している部分を用います。常識的には寒天培地からコルクボーラーで抜いたディスクを使います。ろ紙に液体培地をしみこませてその上で菌を育てておいた菌糸シートイノキュラムを使ってもいいでしょう。糖分の持ち込みを避けるなら菌糸シートイノキュラムを殺菌水ですすいで使います。どんなイノキュラム形態が適切かは菌の生理的特性に依存します。
雑菌の侵入を防ぐため、根系または植物体全体を容器に密封します。いろいろな容器が考案されており、Methods in Microbiology volume23 (Norris, Read and Varma, Academic Press, 1991)などに記述されています。軟式のもの(growth pouch)も用いられますが、私は専ら硬式のもの(袋ではなく箱ということ)を使っています。
基本的には、信州大学の山田明義先生が日菌報に書かれた記事とかMycorrhizaに載った論文とかを参照してください。そのうち私なりの解釈で書いてみますが、所詮二次情報ですから…。
上記奈良教育大学の菊地さんに教わった方法を一部改変したものです。地上部を外に出すことと、透明な蓋を通して連続的な観察が可能なことが特徴です。上の本にたくさん書かれているもののひとつ、Wang の方法に比較的近いでしょう。
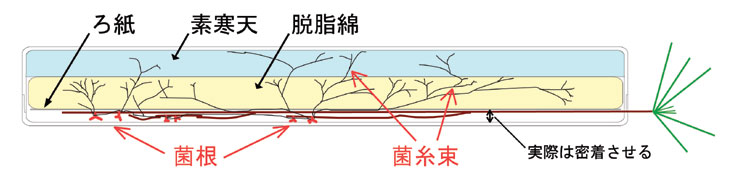
サンプラテックのスチロール角形ケースNo.4を基本にしています。地上部を外に出すための加工として、蓋の縁に深い切り込みを入れます。身の方も対応する位置を浅く削ります。図では説明の都合上根が蓋から離れていますが、実際は密着させますので、その分蓋の縁はぎりぎりまで削る必要があります。具体的には細いドリルで苗を通す位置に穴を開けてから、きわめて目の細かいノコギリで縁から切り込みを入れるようにしています。工具の詳細はtipsのページの当該項目へ。
次に、遮光のため側面を黒く塗ります。その前に、ケースの製造時に付着した離型剤と切削作業中に出た削りかすの除去のため、柔らかいスポンジを用いて洗剤と温水で洗浄します。塗料としてはラッカー系のもので、プラスチックに使えるタイプが一番間違いありません。プラモ用のものがぴったりです。マスキングしてスプレーで塗ってもいいのですが、蓋と身のかみ合わせと切り欠きの部分の処理が難しいので、筆で塗った方が早いかもしれません。どうしても塗りむらが生じて結構光が透けるので、少なくとも二度塗りは必要です。このステップを省略してアルミホイルで包む方法もあり、遮光はむしろそちらの方が完全ですが、観察時にいちいち剥がして巻いてでは数が多い場合には手間がかかりすぎると思います。
加工を施したケースは殺菌しなければいけません。しかしスチロールは70℃くらいで軟化してしまうので、オートクレーブは使えません。エチレンオキサイドガスも今は実験室レベルでは使えないので、過酸化水素を使います。これの利点は強力な酸化剤である上に蒸発して跡を残さないこと、分解産物が無害なことです。さらし粉など不揮発性の薬品と違い、消毒のあと殺菌水ですすぐ手間が要りません。理屈の上ではきれいに洗って殺菌灯を当てればそれなりに無菌になりそうなものですが、試しにクリーンベンチで殺菌灯を一晩当てたらスチロールが飴色になってしまいました。ぎゃぼー。
 左半分が変色したスチロールケース
左半分が変色したスチロールケース
過酸化水素はスプレーして殺菌します。30%過酸化水素は、ほんのわずかでも手につくと少し間をおいて皮膚が白くなって激痛が走るという劇薬(経験者は語る―酸素の泡なのでしばらく耐えれば跡も残さずきれいに消えますが、何十年かしてガンになるかどうかはまだ分かりません(^^;がとりあえず30年無事でいます)なので、作業には保護眼鏡(普段の眼鏡でOK、クリーンベンチが安全キャビネットタイプなら不要)、マスク(ガーゼで充分)、ゴム手袋、白衣程度は必要です。ゴム手袋は使い捨て極薄タイプがよいでしょう。過酸化水素は普通は圧力逃がし弁付きの瓶に入っているはずですが、密封すると破裂の恐れがあって危険なのは常識ですね(塩化鉄運んだタンク車でそのまま過酸化水素を運んで首都高の上で大爆発、なんて事件もありました)。
30%の過酸化水素水原液だけでは、離型剤が除去してあってもケース表面の濡れ性に問題があるので、噴霧してもうまく殺菌できません。そのため展着剤兼用の純エタノールと1:1に混合したものを用います。これでも完全には濡れませんが、ケース内側にできるだけまんべんなく吹き付けます。中に溜まるほどたくさん吹き付ける必要はありません。ていうか溜まっても無駄で邪魔なので捨てましょう。捨てる先は次に滅菌する容器にすれば無駄にならないかも。
なお、言うまでもありませんがこの混合液は大変危険な「毒の霧」です(もちろん緑色ではありません)から、十分な防護措置を採らなければなりません。本来ドラフトでやるべき(クリーンベンチでなければならないことはない)作業ですが、実験室を閉め切って実験台の上にケースを並べて一気に吹き付けてしまうという、いささか(じゃないだろオイ)危ない方法でやったこともありますが(あぶねえ学生だな)、無茶はやめましょう。噴霧作業中はもちろん火気厳禁です。可燃物(スチロール)に対し可燃物(エタノール)に薄いとはいえ酸化剤(過酸化水素)混ぜたものをかけるとか、ねえ。
100個以上とか数が多い場合は、吹き付けたらすぐにケースの蓋を閉め、段ボール箱に入れます。このとき切り欠きが箱の奥の方を向くように。段ボール箱には、底の継ぎ目から外気が入るのを防ぐため、箱より一回り大きい紙(新聞紙など)をあらかじめ底に入れて、同じ消毒剤を噴霧しておきます。
段ボール箱にケースを納めたら箱を閉じて送風乾燥機に入れ、60℃程度でなるべく弱く風を送りながら数日間かけてゆっくり殺菌しつつ過酸化水素を揮発させます。何だか酢臭いような、エステル臭いような変な匂いがしますので換気を十分に。段ボールを用いるのは、もちろん箱を通して消毒剤を揮散させるためです。プラスチックコンテナなどを使うと通気が悪いため、その分余計に時間がかかります。だからといってコンテナ内部に風を通すと汚染のおそれがあります。万一温度がスチロールの軟化点に達してしまうとえらいことになりますから、絶対に65℃を超えないように注意します。温度の均一化という点でも送風乾燥機は有効です。
2-3日して消毒剤が揮散しきった頃を見計らって、箱ごと速やかにクリーンベンチに持ち込みます。のんびりしていると箱が冷めて内部の空気が収縮し、外から雑菌を含んだ空気を吸い込んでしまいます。きのこ栽培で言うところの「戻り空気による汚染」です。クリーンベンチ内で中身の乾き具合をチェックして、もしも消毒剤が残っているケースがあったら蓋を開けて乾かします。乾いていないケースが多いようなら乾燥機に逆戻り。この処理でほぼ完全に無菌にできますが、切り欠きに伴う開口部があるので無菌のまま維持することはできません。そのため殺菌後は速攻で使う必要があるので、がんばって無菌苗の生長とケースの乾燥終了をきっちり同期させる必要があります。無菌苗を2-3ロット時間差で作っておいてケースの準備ができたときにステージの合っていたものを使用するという手もあります。
数が少なくてクリーンベンチに余裕がある場合は、スプレーしたあとクリーンベンチに持ち込んで、身と蓋のそれぞれについて余分な液を振り切って、そのまま乾かすこともできます。振り切るだけではなく薬局で売っている滅菌ガーゼで拭き取るようにすると、わりとすぐ乾きます。数十個ならこっちの方が現実的ですね。
ケースの中身はどのような実験を行うかによって異なります。上の図に示したのは単純に菌根を合成するための装置で、ケースの身の部分に栄養分を含まない素寒天を50-80mlくらい(もちろんケースサイズに依存)入れて、その上にクッションとなる脱脂綿を入れます。カット綿を使ってもいいですし、自分で裁断機で切ってもいいでしょう。ふつう脱脂綿はシート状になっているので、崩さないように広げて適当なサイズに切ります。はさみで切ることもできます。裁断機というのは、事務用品のあれです。レバーで刃を押し下げて紙を切る道具。ちょっとこつがいります。上からもしっかり押さえて固定して切ること。事務のお姉さんと仲良くなっておいて事務室の電動式のを使わせてもらうとすごく能率よく作業できます。脱脂綿は水に浸して軽く絞ると驚くほど体積が小さくなりますが、必ずしも絞ってつぶした状態で使うことはなく、ピンセットで引っ張って空気を含ませても問題ありません。でもケチらない方がいいですね。短期なら寒天も脱脂綿も使わず湿ったバーミキュライトだけを詰めたこともあります。
脱脂綿の適量は、全体に水がなじんだら軽く押さえるとケースの蓋が閉まって手を離しても開かない程度。市販脱脂綿を自分で適当なサイズに裁断する場合、だいたい3g程度にしています。が、これはロット依存なのでテストをして決める必要があります。少なすぎるとろ紙の上の根が蓋に密着しませんし、うまく水が移動しません。水の量も重要で、蓋を閉めるときにあふれるのは論外、端をつまんで斜めに持ち上げると滴ったりするようでは多すぎです。テストでパラメータを決めてください。一応寒天が50mlの時は水はそれよりやや少ないくらいを目安にしています。かなりびちょびちょです。もっと減らしてもよいでしょう。寒天80mlに水20mlでやることもあります。脱脂綿の品質などに依存しますので、テストテスト。あと、なるべく上等な脱脂綿をお勧めします。安物は繊維が短くてリント(綿くず)だらけになるわちぎれやすいわ、ひどいのになると水を吸いにくいわ、いいことありません。
無菌の脱脂綿をピンセットで必要量ケースに詰めるのは、事前に必要なサイズに裁断してあっても少々手間です。ていうか、裁断済みでないと無理。医療用の滅菌済み綿球もいいかも知れません(コストがかかりそうですが)。寒天を増やすと作りやすいですが、特に夏場は寒天が固まるまでに余計に時間がかかります。季節を問わず、作業中に待ち時間が発生してしまうときは、ケースに流し込む寒天が固まってしまわないようにホットプレートやウォーターバスで溶けた寒天を保温したり、分注器を使うならバルブ内部で固まらないよう時々ピストンを動かしてやるなどの対応が必要になります。寒天をいくつかに分けてオートクレーブにかけて、余熱で熱いオートクレーブの中に置いておいて順次取り出すという手もあります。
固まった寒天の上に脱脂綿などを詰めたら、仕上げに角形ろ紙をケース内寸に合わせて切ってオートクレーブしたものを一番上に乗せます(って料理かい)。最初に裁断した脱脂綿とろ紙とをミルフイユ状態で滅菌缶(クッキーの缶でもいいですが―戻り空気による汚染に注意)に入れてオートクレーブしておいて、一組ずつケースに入れてそっと規定量の滅菌水をかけるという方法もあります。このケースの中身自体もまだまだ改善の余地が大いにあるでしょう。工夫して下さい。
ケースの内容物を詰めたら、苗床の無菌容器から無菌苗を取り出して植え付けます。適期は直根が5-8cmくらいになった頃から側根が出始めた頃までです。植え付けるときにどうしても多少根が傷みますが、根端が傷ついた場合は少し上から代替の根が発生します。場合によっては少し長く置いた無菌苗を根切りして用いてもいいでしょう。また、若い芽生えの軸は脆弱なので、苗床から取り出すのに使うピンセットの火炎滅菌後の冷却が不十分だと火傷でだめにしたり、単純に力を入れすぎてつまみ潰したりすることがあり、慎重な操作が必要です。火傷防止には、殺菌水のビーカーを用意しておいて、焼いたピンセットは都度そこで冷ますのが効果的です。ただしそれが汚染源になると最悪なので絶対にコンタミさせないように。複数のビーカーを用意して取り替えていけば、万一作業中に汚染してもそのあとの全部がやられることは防げます。
取り出した苗をろ紙の上に置き、地上部を切り欠きから外に出します。蓋をして、軽く押さえて根とろ紙を蓋に密着させます。うまくいかないときは苗を蓋に置いて濡れたろ紙をかけてから身と合わせます。接種を行うのは苗をろ紙に置く段階でです。培養した菌糸体や寒天片などを根の周囲に適宜置いてやります。これから発生する新根と接触するように配置するのがポイント。
蓋をしたら、周囲を粘着テープで封じて乾燥やコンタミを避けます。プラスチックでできた絶縁テープが適度な伸縮性もあって適しています。とはいえ伸縮性があるからといって強くテンションをかけて貼ると、時間とともにずれてしまいます。あまり引っ張らずに貼りましょう。ビニールの絶縁テープもまあいいのですが、伸縮性がありすぎて時間が経つとずれやすい上に跡に糊が残ってずるずるになりやすいのでいまひとつ。セロハンテープは水に弱いので向きません。プラスチックと合成樹脂系粘着材を使ったテープなら使えます。
次に切り欠き部分の隙間をラノリン(やワセリン)で封じます。ラノリンはるつぼや小さなビーカーに入れてガスバーナーであぶり、全体に溶けて透明な液体になるまで加熱してから使います。この段階で充分に滅菌されるはずですが、気になるなら事前にオートクレーブしてもいいでしょう。作業中に固まってきますから、ミクロスパーテルを軽くあぶってすくい取り、温度が下がって粘性が上がってきたタイミングで切り欠き部分に塗りつけます。高温すぎてさらさらの液体では流れてしまいますし、苗を傷めます。低温過ぎてもうまく付きませんが、ちょっとぼってり付いてしまったものを後から熱いミクロスパーテルで整形するのは簡単なので、固まりかけくらいの温度でやってもいいでしょう。苗の周囲を封じたら、今度は少し温度が高いものを使って流すようにして蓋の切り欠きの縁をしっかり封じます。いずれにしろ本番前にちょっと練習した方がいいでしょう。
試しに一般機械潤滑用のグリスを使ってみたら、案外いけます。オートクレーブして冷まして塗るだけ。加熱しないでも扱いやすい固さなので、もしかしたらラノリンよりこちらの方が優れているかも知れません。あと安いし。
完成した接種装置は上下逆さまに、つまり蓋を下にして積み重ねます。こうすれば重力屈性により根が蓋に沿って伸びます。蓋を上にして置くと、あっという間に根がろ紙を突き破って寒天まで潜り込んでしまいます。本来横向きではなく地上部を上にするのがよいのでしょうが、脱脂綿に含まれた水が重力で下に移動してしみ出してコンタミの原因となります。水の量を加減するなどしてその問題に対応するなら、立てて置いても構いません。その場合、蓋から光が入らないようにアルミ箔や板などで遮光する必要があります。もちろん横置きでも上下の遮光は必要です。ある程度傾けたスタンドを作ってその上に置くというのもよいでしょう。接種直後は馴化のため高湿度弱光の環境に数日間おきますが、苗の状態によっては省略可能なこともあります。
水平に置くにしろ傾斜または垂直に置くにしろ、十分な照明が必要です。そのために組織培養用照明棚(ライトバンク)を使えるならもちろんそれで構いませんが、明るさが足りるかどうか気をつけた方がよいでしょう。照明棚は高価ですが、手作りすることもできます。市販のメッシュラックかアングル棚にトラフ型の蛍光灯器具を取り付けるだけです。室内灯によく用いられている40W型直管蛍光灯器具は長さが約1.2m強なので、1200mm幅の棚を組めば僅かにはみ出す程度で収まります。私は棚の奥の面に蛍光灯を横向きに二段に設置して、その手前に接種装置を置いてやりました。上段の棚板の下に設置して上から照らすこともできますが、蛍光灯とはいえ結構な発熱量があるので上段の温度には注意すべきです。効率改善のためには蛍光管に取り付ける反射板が有効です。はっきり分かるくらい明るくなりました。なお、蛍光灯器具の説明書には電気工事士の資格が必要と書いてありますが、普通この種の器具は天井などに電気工事を行って設置するものであり、その場合には当然資格が必要になるということです。
蛍光灯にも種類があり、器具との対応が問題になります。安くすませるならグロー管式(スタータ式と呼ばれます)の蛍光灯器具とそれ用の白色灯。植物育成用の特殊蛍光管もあり、私が知っているものにはNECのビオルックスA, HGや、パナソニックの植物用蛍光灯があります。この手の実験でメタハラまで使うことはないでしょう。メタハラとはメタルハライドランプのことで、HIDの一種です。ていうか、水銀灯。