 左半分が変色したスチロールケース
左半分が変色したスチロールケース植物と菌根菌だけの系での接種、菌根合成について。「無菌系」と言うこともありますが、菌根「菌」はいるのですから、その言い方はちょっと変ですね。
# こーゆー実験の方法について、M大学のM先生に森林学会で何度も「前世紀的」っていわれちゃった、しゅーん。とか言ってみる。
普通は純粋培養した菌糸体を使います。時には汚染のないよう注意して得た胞子を用いる場合もあります。胞子紋をとるようにして直接無菌の根に胞子を落としてやることも。あまり胞子が飛ばないからとしばらく置いておいたらキノコバエの幼虫が培地を這ってたなんてこともありました。案外コンタミしないんですよね、それでも。まあ気持ち悪いのでそういうのは使いませんが。
分離や培養については別項に書きましたが、そのようにして得た菌株の旺盛に生育している部分を用います。常識的には寒天培地からコルクボーラーで抜いたディスクを使います。ろ紙に液体培地をしみこませてその上で菌を育てておいた菌糸シートイノキュラムを使ってもいいでしょう。糖分の持ち込みを避けるなら菌糸シートイノキュラムを殺菌水ですすいで使います。どんなイノキュラム形態が適切かは菌の生理的特性に依存します。
雑菌の侵入を防ぐため、根系または植物体全体を容器に密封します。いろいろな容器が考案されており、Methods in Microbiology volume23 (Norris, Read and Varma, Academic Press, 1991)などに記述されています。軟式のもの(growth pouch)も用いられますが、私は専ら硬式のもの(袋ではなく箱ということ)を使っています。
勝手に名前を付けましたが、信州大学の山田明義先生が日菌報に書かれた記事とかMycorrhizaに載った論文とかを参照してください。
上記奈良教育大学の菊地さんに教わった方法を一部改変してさらにいじったものです。地上部を外に出すことと、透明な蓋を通して連続的な観察が可能なことが特徴です。上の本にたくさん書かれているもののひとつ、Wang の方法に比較的近いでしょう。
サンプラテックのスチロール角形ケースNo.4を基本にしています。ポイントは、倒立にすること。蓋を下にします。利点は蓋を開けることで菌根に直接アクセスができること。ケースの加工が少し楽というのも数が多いと馬鹿にできません。あと使っていて割れにくいし。もちろん反復使用が前提です。
地上部を外に出すための加工として、蓋の縁に幅2mmくらいの深い切り込みを入れます。身の方も対応する位置を浅く削ります。細めで細目の丸ヤスリ(φ5くらい)でひと削り。図では説明の都合上根が蓋から離れていますが、実際は密着させますので、その分蓋の縁はぎりぎりまで削る必要があります。具体的には細いドリルで苗を通す位置に穴を開けてから、きわめて目の細かい精密のこぎりで縁から切り込みを入れるようにしています。工具の詳細はカミソリ鋸によるプラスチック加工へ。
次に、ケースの製造時に付着した離型剤と切削作業中に出た削りかすの除去のため、柔らかいスポンジを用いて洗剤と温水で洗浄します。洗浄して乾燥したら、遮光のため側面を黒く塗ります。蓋面と底面は残して。塗料としてはラッカー系のもので、プラスチックに使えるタイプなら大丈夫です。マスキングしてスプレーで塗ってもいいのですが、蓋と身のかみ合わせと切り欠きの部分の処理が難しいので、筆で塗った方が早いかもしれません。どうしても塗りむらが生じて結構光が透けるので、少なくとも二度塗りは必要です。このステップを省略してアルミホイルで包む方法もあり、遮光はむしろそちらの方が完全ですが、観察時にいちいち剥がして巻いてでは数が多い場合には手間がかかりすぎると思います。
加工を施したケースは殺菌しなければいけません。しかしスチロールは70℃くらいで軟化してしまうので、オートクレーブは使えません。エチレンオキサイドガスも今は実験室レベルでは使えないので、過酸化水素を使います。これの利点は強力な酸化剤である上に蒸発して跡を残さないこと、分解産物が無害なことです。さらし粉など不揮発性の薬品と違い、消毒のあと殺菌水ですすぐ手間が要りません。理屈の上ではきれいに洗って殺菌灯を当てればそれなりに無菌になりそうなものですが、試しにクリーンベンチで殺菌灯を一晩当てたらスチロールが飴色になってしまいました。ぎゃぼー。
 左半分が変色したスチロールケース
左半分が変色したスチロールケース
過酸化水素はスプレーして殺菌します。30%過酸化水素は、ほんのわずかでも手につくと少し間をおいて皮膚が白くなって激痛が走るという劇薬(経験者は語る―酸素の泡なのでしばらく耐えれば跡も残さずきれいに消えますが、何十年かしてガンになるかどうかはまだ分かりません(^^;)なので、作業には保護眼鏡、マスク、ゴム手袋、白衣程度は必須です。ゴム手袋は手術用などの使い捨て極薄タイプがよいでしょう。過酸化水素は普通は圧力逃がし弁付きの瓶に入っているはずですが、密封すると破裂の恐れがあって危険なのは常識ですね。鉄さびが触媒になることとかも(塩化鉄運んだタンク車でそのまま過酸化水素を運んで首都高の上で大爆発、なんて事件もありました)。30%の原液だけでは離型剤が除去してあってもケース表面の濡れ性に問題があるので、展着剤兼用の純エタノールと1:1に混合したものを用います。これでも完全には濡れませんが、ケース内側にできるだけまんべんなく吹き付けます。中に溜まるほどたくさん吹き付ける必要はありません。ていうか溜まっても無駄で邪魔なので捨てましょう。
なお、言うまでもありませんがこの混合液は大変危険な「毒の霧」です(もちろん緑色ではありません)から、十分な防護措置を採らなければなりません。本来ドラフトでやるべき(クリーンベンチの必要はない)作業ですが、実験室を閉め切って実験台の上にケースを並べて一気に吹き付けてしまうという、いささか(じゃないだろオイ)危ない方法でやったこともありますが(あぶねえ学生だな)、無茶はやめましょう。噴霧作業中はもちろん火気厳禁です。可燃物(スチロール)に対し可燃物(エタノール)に薄いとはいえ酸化剤(過酸化水素)混ぜたものをかけてフランベだなんて(しませんよ)、ヴァルター機関じゃあるまいし。
100個以上とか数が多い場合は、吹き付けたらすぐにケースの蓋を閉め、段ボール箱に入れます。このとき切り欠きが箱の奥の方を向くように。段ボール箱には、底の継ぎ目から外気が入るのを防ぐため、箱より一回り大きい紙(新聞紙など)をあらかじめ底に入れて、同じ消毒剤を噴霧しておきます。
段ボール箱にケースを納めたら箱を閉じて送風乾燥機に入れ、60℃程度でなるべく弱く風を送りながら数日間かけてゆっくり殺菌しつつ過酸化水素を揮発させます。当たり前ですが何だか酢臭いような、エステル臭いような変な匂いがします。換気を十分に。段ボールを用いるのはもちろん箱を通して消毒剤を揮散させるためです。プラスチックコンテナなどを使うと通気が悪いため、その分余計に時間がかかります。だからといってコンテナ内部に風を通すと汚染のおそれがあります。万一温度がスチロールの軟化点に達してしまうとえらいことになりますから、絶対に65℃を超えないように注意します。温度の均一化という点でも送風乾燥機は有効です。
2-3日して消毒剤が揮散しきった頃を見計らって、箱ごと速やかにクリーンベンチに持ち込みます。のんびりしていると箱が冷めて内部の空気が収縮し、外から雑菌を含んだ空気を吸い込んでしまいます。きのこ栽培で言うところの「戻り空気による汚染」です。クリーンベンチ内で中身の乾き具合をチェックして、もしも消毒剤が残っているケースがあったら蓋を開けて乾かします。乾いていないケースが多いようなら乾燥機に逆戻り。この処理でほぼ完全に無菌にできますが、切り欠きに伴う開口部があるので無菌のまま維持することはできません。そのため殺菌後は速攻で使う必要があるので、がんばって無菌苗の生長とケースの乾燥終了をきっちり同期させる必要があります。無菌苗を2-3ロット時間差で作っておいてケースの準備ができたときにステージの合っていたものを使用するという手もあります。
数が少なくてクリーンベンチに余裕がある場合は、スプレーしたあとクリーンベンチに持ち込んで、身と蓋のそれぞれについて余分な液を振り切って、そのまま乾かすこともできます。振り切るだけではなく薬局で売っている滅菌ガーゼで拭き取るようにすると、わりとすぐ乾きます。数十個ならこっちの方が現実的ですね。
菊地式のバリエーションです。ケースにサンプラテックのNo. 15を使います。ケースにある程度のボリュームがある土壌を充填するために作りました。目的から菌根にアクセスする必要はないので、こちらはケースの身の方を下にします。苗木の根はケースの底を経由して観察します。
作り方は菊地式とほぼ同じ。ケースの短辺側に縁から底までスリットを入れます。細いドリルと精密のこぎりで慎重に切削します。モノが大きいのでスリットの底に応力集中が起きやすくなり、うっかりするとクラックが入ります。ちょっとくらいなら大丈夫ですが。
周囲の遮光塗装も同じです。強い光源を使う場合、光源に面するスリット側の面にアルミテープを貼ってほぼ完全遮光にする場合もあります。スリット断面などがあるので本当の完全遮光にするのはやや困難です。また、蓋面・底面からの光漏れを完全に防ぐのはまず不可能です。それらの面をアルミ板などで遮蔽しても、どこかに隙間があれば光は漏れてきます。No. 15はかみ合わせスタックになるので、丁寧に塗装すればそこそこ光は防げるでしょう。
スリットを通して実生を置いて、充填物などを入れて蓋をします。スリットが丸ごと開いたまま残るのはいろいろ具合が悪いので、非滅菌系であれば実生を置いた段階で内側から粘着テープを貼ってしまいます。一番いいのはアルミテープ。ただし純粋系で使ったことはありません。マフラー(襟巻きではありません)修理用の耐熱アルミテープならオートクレーブにも耐えるかも。実生とのわずかな隙間が問題になる場合は、るつぼなどの小容器にとってオートクレーブしたワセリンやラノリン、またはただのグリスを塗りつけて塞ぎます。
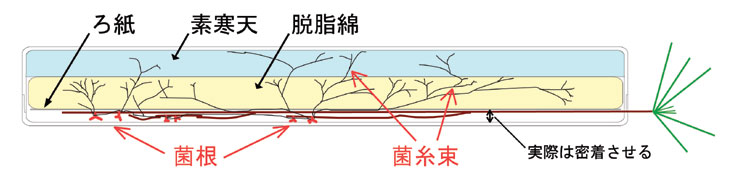
ケースの中身はどのような実験を行うかによって異なります。上の図に示したのは単純に菌根を合成するための装置で、No. 4ケースの身の部分に栄養分を含まない素寒天を50-80mlくらい(もちろんケースサイズに依存)入れて、その上にクッションとなる脱脂綿を入れます。ちょっとくらいならカット綿を使ってもいいですし、自分で切ってもいいでしょう。ふつう脱脂綿はシート状になっているので、崩さないように広げて適当なサイズに切ります。はさみで切ることもできますが、事務用品の裁断機を使うと能率がよく、寸法も管理しやすいでしょう。
ある程度の量を使うなら、ロール綿がよいでしょう。かさばりませんし、寸法が安定しています。あと、脱脂綿はなるべく上等なものをお勧めします。安物は繊維が短くてリント(綿くず)だらけになるわちぎれやすいわ、ひどいのになると水を吸いにくいわ、いいことありません。
裁断機の中でもレバーで刃を押し下げて紙を切るタイプが適しています。ローラーカッター式は向きません。事務室の電動裁断機を使わせてもらうとすごく能率よく作業できます。脱脂綿は水に浸して軽く絞ると驚くほど体積が小さくなりますが、必ずしも絞ってつぶした状態で使うことはなく、ピンセットで引っ張って空気を含ませても問題ありません。でもケチらない方がいいですね。短期なら寒天も脱脂綿も使わず湿ったバーミキュライトだけを詰めたこともあります。
脱脂綿の適量は、全体に水がなじんだら軽く押さえるとケースの蓋が閉まって手を離しても開かない程度。市販脱脂綿を自分で適当なサイズに裁断する場合、だいたい3g程度にしています。が、これはロット依存なのでテストをして決める必要があります。少なすぎるとろ紙の上の根が蓋に密着しませんし、うまく水が移動しません。水の量も重要で、蓋を閉めるときにあふれるのは論外、端をつまんで斜めに持ち上げると滴ったりするようでは多すぎです。テストでパラメータを決めてください。一応寒天が50mlの時は水はそれよりやや少ないくらいを目安にしています。かなりびちょびちょです。もっと減らしてもよいでしょう。寒天80mlに水20mlでやることもあります。脱脂綿の品質などに依存しますので、テストテスト。
無菌の脱脂綿をピンセットで必要量ケースに詰めるのは、事前に必要なサイズに裁断してあっても少々手間です。ていうか、裁断済みでないと無理。医療用の滅菌済み綿球もいいかも知れません(コストがかかりそうですが)。寒天を増やすと作りやすいですが、特に夏場は寒天が固まるまでに余計に時間がかかります。季節を問わず、作業中に待ち時間が発生してしまうときは、寒天が固まってしまわないようにホットプレートやウォーターバスで溶けた寒天を保温したり、分注器を使うならバルブ内部で固まらないよう時々ピストンを動かしてやるなどの対応が必要になります。寒天をいくつかに分けてオートクレーブにかけて、スイッチを切ったオートクレーブの中に置いておいて順次取り出すという手もあります。
固まった寒天の上に脱脂綿などを詰めたら、仕上げに角形ろ紙をケース内寸に合わせて切ってオートクレーブしたものを一番上に乗せます(って料理かい)。最初に裁断した脱脂綿とろ紙とをミルフイユ状態で滅菌缶(クッキーの缶でもいいですが―戻り空気による汚染に注意、滅菌後速やかにクリーンベンチまで運ぶこと)に入れてオートクレーブしておいて、一組ずつケースに入れてそっと規定量の滅菌水をかけるという方法もあります。かさばるので少数なら。この手順もケースの中身自体もまだまだ改善の余地が大いにあるでしょう。工夫して下さい。
ケースの内容物を詰めたら、苗床の無菌容器から無菌苗を取り出して植え付けます。適期は直根が5-8cmくらいになった頃から側根が出始めた頃までです。植え付けるときにどうしても多少根が傷みますが、根端が傷ついた場合は少し上から代替の根が発生します。場合によっては少し長く置いた無菌苗を根切りして用いてもいいでしょう。また、若い芽生えの軸は脆弱なので、苗床から取り出すのに使うピンセットの火炎滅菌後の冷却が不十分だと火傷でだめにしたり、単純に力を入れすぎてつまみ潰したりすることがあり、慎重な操作が必要です。火傷防止には、殺菌水のビーカーを用意しておいて、焼いたピンセットは都度そこで冷ますのが効果的です。ただしそれが汚染源になると最悪なので絶対にコンタミさせないように。複数のビーカーを用意して取り替えていけば、万一作業中に汚染してもそのあとの全部がやられることは防げます。
取り出した苗をろ紙の上に置き、地上部を切り欠きから外に出します。蓋をして、軽く押さえて根とろ紙を蓋に密着させます。うまくいかないときは苗を蓋に置いて濡れたろ紙をかけてから身と合わせます。接種を行うのは苗をろ紙に置く段階でです。培養した菌糸体や寒天片などを根の周囲に適宜置いてやります。これから発生する新根と接触するように配置するのがポイント。木化した根に触れてもあまり意味がありません。
蓋をしたら、周囲を粘着テープで封じて乾燥やコンタミを避けます。プラスチックでできた絶縁テープが伸縮性もあって適しています。とはいえ伸縮性があるからといって強くテンションをかけて貼ると、時間とともにずれてしまいます。あまり引っ張らずに貼りましょう。ビニール絶縁テープもまあいいのですが、伸縮性がありすぎて時間が経つとずれやすい上に跡に糊が残ってずるずるになりやすいのでいまひとつ。セロハンテープは水に弱いので向きません。プラスチックと合成樹脂系粘着材を使ったテープなら使えます。
次に切り欠き部分の隙間をラノリン(やワセリン)で封じます。ラノリンはるつぼや小さなビーカーに入れてバーナー上であぶり、全体に溶けて透明な液体になるまで加熱してから使います。気になるなら事前にオートクレーブしてもいいでしょう。作業中に固まってきますから、ミクロスパーテルを軽くあぶってすくい取り、温度が下がって粘性が上がってきたタイミングで切り欠き部分に塗りつけます。高温すぎてさらさらの液体では流れてしまいますし、苗を傷めます。低温過ぎてもうまく付きませんが、ちょっとぼってり付いてしまったものを後から熱いミクロスパーテルで整形するのは簡単なので、固まりかけくらいの温度でやってもいいでしょう。苗の周囲を封じたら、今度は少し温度が高いものを使って流すようにして蓋の切り欠きの縁をしっかり封じます。いずれにしろ本番前にちょっと練習した方がいいでしょう。
完成した接種装置は上下逆さまに、つまり蓋を下にして積み重ねます。こうすれば重力屈性により根が蓋に沿って伸びます。蓋を上にして置くと、あっという間に根がろ紙を突き破って寒天まで潜り込んでしまいます。本来横向きではなく地上部を上にするのがよいのでしょうが、脱脂綿に含まれた水が重力で下に移動してしみ出してコンタミの原因となったりする恐れがあります。水の量を加減するなどしてその問題に対応するなら、立てて置いても構いません。その場合、蓋から光が入らないようにアルミ箔や板などで遮光する必要があります。もちろん横置きでも上下の遮光は必要です。ある程度傾けたスタンドを作ってその上に置くというのもよいでしょう。接種直後は馴化のため高湿度弱光の環境に数日間おきますが、苗の状態によっては省略可能なこともあります。
水平に置くにしろ傾斜または垂直に置くにしろ、十分な照明が必要です。そのために組織培養用照明棚(ライトバンク)を使えるならもちろんそれで構いませんが、明るさが足りるかどうか気をつけた方がよいでしょう。照明棚は高価ですが、手作りすることもできます。市販のメッシュラックかアングル棚にトラフ型の蛍光灯器具を取り付けるだけです。室内灯によく用いられている40W型直管蛍光灯器具は長さが約1.2m強なので、1200mm幅の棚を組めば僅かにはみ出す程度で収まります。私は棚の奥の面に蛍光灯を横向きに二段に設置して、その手前に接種装置を置いてやりました。上段の棚板の下に設置して上から照らすこともできますが、蛍光灯とはいえ結構な発熱量があるので上段の温度には注意すべきです。効率改善のためには蛍光管に取り付ける反射板が有効です。はっきり分かるくらい明るくなりました。なお、蛍光灯器具の説明書には電気工事士の資格が必要と書いてありますが、普通この種の器具は天井などに電気工事を行って設置するものであり、その場合には当然資格が必要になるということです。
蛍光灯にも種類があり、器具との対応が問題になります。安くすませるならグロー管式(スタータ式と呼ばれます)の蛍光灯器具とそれ用の白色灯。植物育成用の特殊蛍光管もあり、私が知っているものにはNECのビオルックスA, HGや、パナソニックの植物用蛍光灯があります。この手の実験でメタハラまで使うことはないでしょう。メタハラとはメタルハライドランプのことで、HIDの一種です。ていうか、水銀灯。
基本的に二者培養系での作業と同じです。無菌性に気を遣う必要がないのでたいへん気が楽です。一部違う点もありますので、そこについて。
消毒したマツの種子を発芽させます。無菌にする必要はありませんが、無菌根を維持する必要があるので、それなりの工夫が必要です。
開放系では無菌性検定は不要ですが、発芽を揃えるための促進処理は行った方が斉一な実生が得られます。無菌系と同様にホルモン処理を行うこともできますが、開放系ならではの方法として物理的に殻割りを行うこともできます。その方法は、十分吸水した種子の尖った部分を両脇からピンセットか爪の先で軽くつまんで「プチッ」と割るというものです。種子は全体にやや扁平で、尖った部分には側面に稜線がありますが、発芽時にはこの線から割れます。そのため、稜線上を爪でつまんで、内部の幼根を傷つけないようにそっと力をかけて割って吸水と幼根の伸長を助けてやります。
 クロマツ種子をピンセットでつまんだところ、この稜線部を軽くつまんで割ってやる
クロマツ種子をピンセットでつまんだところ、この稜線部を軽くつまんで割ってやる
接種まではバーミキュライトや砂などの素材で育成します。開放系とはいえ目的外の菌根菌の混入を防ぐため、清潔な材料をいったんオートクレーブして使うようにします。これには材料を水になじませるという意味もあります。あまりきれいでない、有機物が混ざっているようなものを使うと、オートクレーブ後に微生物的空き家になってトリコデルマやペニシリウムが大繁殖したりするおそれがあります。変なものが煮えていやーな臭いがしていたり。ただ、アカマツ林のB層土壌ならオートクレーブして使っても問題ないという話も聞きました。
育成期間はおおむね子葉が開ききってから初生葉が伸び始める程度まで。子葉が開きはじめるとついついその先に付いている種子の殻を取ってしまいたくなりますが(ならない?)、これは取ってはいけません。この段階ではまだ中に胚乳が残っていて、取ってしまうと初期生長に響きます。よく分かりませんが子葉の先端から養分を吸収しているように見えます。たまにうまく脱落しないで子葉の先がちぎれたりするものがないこともない(たぶん1%以下)ですが、余計なことをせず自然に開くのを待ちます。子葉が開いたらもう取っても大丈夫です。
ここまで来れば一応接種可能です。もちろんさらにしばらく置いて大きくしても構いません。軸が木化するまで待った方が扱いは容易になります。十分な肥料と水を与えればそのまま無菌根でも生育は可能です。実験室内なら(きのこを持ち込んだりしない限り)菌根のコンタミもまずありません。
無菌系で用いたような接種観察容器を利用することももちろん可能です。しかし開放系ではトリコデルマやペニシリウムが侵入してわけの分からないことになる恐れがあります。このような場合、例えばショウロ・クロマツ系では水の代わりにベノミル0.01%水溶液を用いると雑菌をいくらか抑えることができます。接種観察容器内の脱脂綿を湿らせる水に添加します。別項にも書きましたが抗菌剤への感受性は菌の種類によって異なるので予備試験が必要ですし、この手が使えない菌もあるでしょう。
ショウロでやっている方法です。一応特許になってますので使われるときはご連絡を。森林総研としては、基本的にそれで儲けないならお金は取らないそうですし、法律でも研究のためなら使ってもいいことになっているとか。
成熟したきのこをミキサーにかけて濃厚胞子懸濁液を得ます。具体的なことは菌根性きのこのいくつかについてにも少し書きました。そうやって得た胞子液を適当に薄めて、増粘・ゲル化剤としてアルギン酸ナトリウムを1%加えます。完熟ショウロで作った場合10倍希釈なら確実、30倍でもまず大丈夫でした。ただしこれは原液の品質に影響されます。ここに上記のようにして育てた苗の根を浸して、引き上げると根に胞子ゾルが絡みますからこれを0.1Nくらいの希塩酸にディップして固定します。2%乳酸カルシウムとか0.4N塩化カルシウムとかでも固まるそうですが、胞子はともかく根は脆弱なのであんまり薬品にさらしたくないため、一瞬で固まる塩酸を使っています。作業効率もいいですし。小さな苗ならだいたい1本あたり1グラム前後消費するはずです。10倍希釈の濃厚ゾルを使っても、100本接種するのに胞子原液10g、1:1加水でミキサーにかけたのなら成熟ショウロ5g、ということは2-3個程度必要です。でもこれよりだいぶ薄くてもだいたいうまくいきます。なお、このゲルはすぐに生分解されます。
バリエーションとして、胞子を含むアルギン酸ナトリウムゾルを希塩酸に滴下してゲルにしてから苗の根に与える方法もあります。滴下するときそっとぽたぽた垂らすと何やらタピオカパールのような、濃度によっては赤血球のような形のつぶつぶになるので、すくって用います。胞子の量をきっちり決めたいときにはこの方法を用い、ピペットで一定量吸い上げたゾルをゲル化して与える方がいいでしょう。でもピペット内壁に粘り着くのであんまり正確にはなりません。気に入らないなら希塩酸の入ったビーカーを電子天秤に載せて滴下量を測定し、少しも残さずすくい取ってはゼロ点をあわせ直して次を滴下。
根に胞子ゲルを付けた苗は、そのまま菌根菌を含まない培土で鉢植えしてしばらく育てます。もちろん透明ケースで観察することもできます。植えてから早ければ3週間、遅くても1ヶ月半くらいで菌根ができてきます。ショウロは菌根を作るとすぐに菌糸束を伸ばして周囲に蔓延しようとします。ヤマドリタケモドキもクヌギの根の上で似たような振る舞いを示しました。
(この項未完)