 左半分が変色したスチロールケース
左半分が変色したスチロールケース菌根菌を接種するというと、市販されている緑化資材の「菌根菌」を思い浮かべる方が多いかもしれません。日本で入手できる緑化資材の菌根菌はアーバスキュラー菌根菌の胞子ですが、ここで扱うのはそれとは違います。ここでは外生菌根菌の接種、それも実験的な手法についてです。外生菌根性きのこの発生を目的とするような応用的な手法については、そのうち別項にまとめたいと思っています。
まだまだ未完ですが、ある程度まとまってきました。(2006.09)
なんだか伸びてきたので分割しようかなと思っています。(2007.01)
ますます伸びていますが、さてどう分割しましょうか。図も足りませんねぇ。(2007.05)
だいぶ放置しましたが整備を再開します。(2020.05)
これまで根拠のあるこだわりで「外菌根」という言葉を使ってきましたが、「外生菌根」派に対する形勢がなんというか昭和20年春の日本みたいになってしまったので、もはやこれまでと投降します。以後手を入れるたびに「外生菌根」に置き換えていきます。(2020.08)
お手軽にすませるなら造園業者さんからも購入できますが、品質は生産者次第です。産年と県レベルの産地くらいは分かるでしょうが、その中で系統はいろいろです。遺伝的にそろったものは期待できません。利点としては大量に入手できることです。
ただし家庭菜園の種みたいにいつでもどこでも手に入るわけではありません。年度末が近づいて予算執行の締め切り(12月くらい)が迫った頃に契約依頼したらスムーズに手に入りましたが、購買担当者がどこで調達したのかまでは知りません。
研究用に少量なら、日立市にある森林総研林木育種センターが「遺伝資源の配布」を行っています。産地や遺伝的背景などの情報がしっかりしたものが手に入ります。必要な場合は手続きなどはそちらをご覧下さい。ただし誰にでもくれるわけではなく、事前の打ち合わせが必要です。
購入種子は、業者によって品質がまちまちです。念のためバットに広げて点検した方がいいでしょう。湿っぽいものがあれば水分調整にもなります。あまり量が多くない場合はこの段階で精選してしまいます。方法は下記の自家採種を参照。
手頃なサイズのマツを利用できるなら、Half-sib(片親共通)など素性の分かったものを自分で採ることもできます。ただしアカマツとクロマツとは雑種を作りますから、両種が一緒に植わっているような場所では要注意です。両種をきっちりした方法で識別するには、針葉の断面を観察して、樹脂道が表皮に接していればアカマツ、葉肉中にあればクロマツとします。雑種は中間の形質を示します(吉川ら、アカマツ,クロマツの雑種に関する研究、高知大演習林報告、1987)。なお、木があまり若いとこの方法では雑種がうまく区別できません。
現場での識別方法としては、成木はまあ見ればわかりますし、小さな個体でも冬芽ができている時季には芽が赤いのがアカマツ、白いのがクロマツ(黒くはありません(^^;)というのが分かりやすいでしょう。あと、てのひらで針葉の先に触れて痛いのがクロマツ、痛くないのがアカマツという実にいい加減っぽいものもあります。こんな方法でもアカマツかクロマツかあるいは雑種かの見当がだいたい程度付いたりします。
自家採種の場合、散布される種子を集めるのではなく、種子散布寸前の毬果を取ってそこから種を採ります。タイミングとしてはそろそろ早いものが開き始めたくらいを狙います。高枝切りばさみなどで地上から切り落として毬果を集めます。枝ごと切らなくてもうまくやれば毬果だけを落とすことができます。もちろん木登りでも高所作業車でも、どうぞご安全に。
集めた毬果は段ボール箱に入れます。木箱でもいいですがあまりないですよね。乾燥して毬果が開くと見かけの体積が増えますし、底の方が蒸れても困るので、段ボールに入れるのはせいぜい深さにして10cm程度までにしておきます。底の継ぎ目には種がこぼれないよう内側からガムテープか何かを貼るといいでしょう。段ボール箱を使うのは透湿性のためなので、苗木用などの防湿加工のものは向きません。プラスチックコンテナなど透湿性のない容器を使う場合は、入れる量を減らすなどして対応します。コンテナ内にざるやかごを入れてそこに入れれば上等。毬果が少ない場合は紙袋や封筒も使えます。
毬果を入れた箱は、そのままふたをせずに風通しのいいところに置いて陰干しします。といっても本当に風が吹き抜けるところは当然避けます。天気にもよりますが1週間もすると鱗片が開いて種子がこぼれ落ちてきます。開きにくい毬果は未熟だったり病虫害を受けていたりすることが多いので、きれいな毬果の多くが開いたらよしとします。一気に開くわけではないので、しばらく部屋の隅に放置しておいてもよいでしょう。箱ごと揺すったりかき回したりすると毬果から種子が落ちてくるので、毬果を別の箱に移し、箱の隅に集めて紙袋に採ります。毬果が十分開いていれば、これを数回繰り返せばだいたい落ちきるでしょう。なかなか落ちてこないような種子には粃(しいな、充実していない種子)が多いので、あまりしつこくやるとかえって品質を損ねます。
採れたマツの種子は、軽く揉んだり適当な容器に入れて軽く搗いたりして、種子翼を取り除きます。種子翼は軽いため揺すって表面に集めて捨てます。ふるいを使ってもいいですし、風選ができれば粃も除去できます。種子翼その他の夾雑物はコンタミの元なので、なるべくきれいに除去します。仕上げに米を研ぐ要領で傷が付かない程度に水洗いします。洗ったものは水を切ってペーパータオルや新聞紙の上に広げて乾燥させます。のんびりしていると発芽プロセスが動き出すので手早く。傷が付いたもの、ヒビが入ったものも気がついたら取り除きます。
作業をしていると、妙に軽いものがあります。これが粃です。たいていは色が白いので分かるのですが、エタノール選により比重で選り分けることができます。純エタノールに投入して、浮いたものを捨てて沈んだものだけを取ります。
精選した種子は数日陰干しして、水分を調整したらチャック付きポリ袋に入れて冷蔵します。鳥害に遭わないよう、陰干しは室内で。(実用上)非休眠種子なので、取り出せばすぐに使えます。3年くらい、ものによっては5年くらいまでなら生きていますが、だんだん発芽が揃わなくなってきます。ちなみに種子の重さはアカマツで10mg, クロマツで15mgくらいですが、かなりばらつきがあるので、実験条件を整えるなら大きすぎるものや小さすぎるものは取り除くべきでしょう。ついでに言うとエゾマツは100個で240mgでしたから、1個あたりたぶん2-3mgです。
マツの種子の内部には普通はかびや細菌がいないので、表面だけ殺菌してやれば無菌化ができます。無菌化する必要がなくても、同様に消毒してやるとダンピングオフ(芽生えの集団立ち枯れ)の予防にもなるのでおすすめです。
殺菌剤としては、30%過酸化水素(市販試薬そのまま)で数分処理する人もいますし、アンチホルミンを使う人もいます。大昔はチメロサール(水銀剤!!)を使っていたそうです。私はさらし粉(高度さらし粉)を使います。この方法は学生時代に研究室の先輩だった現九州沖縄農業研究センター龍谷大学の岩堀英晶先生に教わりました。過酸化水素やアンチホルミン(次亜塩素酸ナトリウム水溶液)は要冷蔵で、管理に気をつける必要があります。さらし粉は一番扱いやすいと思いますが、これも保管が悪いと変質する恐れがあります。いずれも要冷蔵です。
さらし粉による表面殺菌で必要なものを挙げます。100粒位(1グラム前後)を処理するスケールで。
さらし粉を使った具体的な種子殺菌処理は、だいたい以下のような感じです。
まず、種子を計量したらきちんと選別して掃除しておきます。これを精選といいます。使える種子に余裕があるなら、最終的な必要種子数の倍くらいを処理するとよいでしょう。中身がスカな粃は、軽いし指でやや強くつまめば潰れるので分かります。傷のある種子は当然だめ、種子翼の残りはコンタミの元なので除去します。必要に応じて大きすぎるものや小さすぎるものも排除します。
さらし粉をだいたい10倍(w/w)の水(当然水道水で可)に加えて溶け残りが出る飽和水溶液とし、種子を加えて1時間おきます。種子は予備洗いなどせずいきなり投入してかまいません。奈良教育大学の菊地淳一先生によると、室温が高ければもう少し短くてもいいそうです。30℃なら40分くらい。種子はさらし粉水溶液に浮く上に表面が水をはじくので、時々かき混ぜて、まんべんなくさらし粉水溶液に触れるようにする必要があります。
最近やっている手抜きっぽいが能率的な方法は、クリーンベンチにマグネチックスターラーを持ち込んで、プラスチックビーカーにさらし粉の粒と水道水を入れて、攪拌しながら種子も投入してしまうというもの。
そのうち全体に漂白されてきますので、うまく液に触れていない部分が残っていれば茶色が残って見当がつきます。アカマツの場合、最後には白ゴマのような色合いになります(さらし粉水溶液から出すと間もなく茶色に戻ります)。クロマツはそこまで変色しません。
時間になったら小さな網杓子(あく取り)あるいは薬さじか何かを使ってすくい取り、殺菌水で洗います。さらし粉水溶液は白濁しているので、種子が流れ出ないよう廃液受けに捨てて、沈んでいる種子も集めます。種子の洗い方は、殺菌水のビーカーに放り込んで薬さじでかき回すだけ。そこからすくい取って次の殺菌水に投入し、合計2回も洗えば十分でしょう。3本作ったのは予備&汎用冷却水&念のため。無菌化までは行わない種子消毒だけなら、さらし粉水溶液からすくい取って水道水で洗えば終了です。
この方法では、殺菌処理に使う容器がガラス製の場合はのんびりしているとさらし粉に侵されるため、プラスチックビーカーを使った方がよいでしょう。ポリプロピレン(PP)ならぎりぎりオートクレーブに耐えます。ガラスビーカーを使った場合、のんびりしていると表面が侵されてしまいますが、使用直後に塩酸で洗えばまず大丈夫です。ステンレスの薬さじも侵されますから使ったあとはすぐに洗う必要があります。殺菌した種子をすくい取った網杓子も、使用後に全体をよく洗います。なお、薄い塩酸で洗うとさらし粉のかすを完全に落とせますが、当然のことながらこびりついていたさらし粉の量に応じて塩素が発生します。間違っても溶け残りのさらし粉に塩酸をかけたりしないように。塩素ガスが沸き出してあわてることになります。微量なら問題ないでしょうが、気になるならドラフトへ。
実用面からは、おやつに食べたプリンのカップと、コンビニやフードコートのパフェについて来たスプーンでいいくらいです。プリンカップはもしかしたらオートクレーブに耐えないかも。パフェスプーンの方が薬さじより使い勝手がいいかも知れません。さらし粉はホームセンターでも手に入るし、やろうと思えば高校の部活でもできますね。
何でも構いませんが適当な栄養寒天培地を使い、殺菌した種子を置いてかびや細菌が出てこないかチェックします。種子は濡れた状態で置きます。置き方はなるべく等間隔にします。私はきのこからの分離の時と同様に1枚19個というパターンでやっています。てきとーに置くこともありますが。必ず毎日チェックして、万一かびが出るものがあったら無事なものを新しい培地に移します。かびた種子を除去しようとしてもたいてい除去しきれません。これもきのこからの菌株分離と同様。月曜に殺菌して金曜までにかびが出てこなければほぼ大丈夫と見なしています。金曜日とかに処理すると週末にチェックすることに。新しい種子なら90%以上の歩留まりが見込めます。古いと保存中に死んでかびなどの侵入を受けた種子の割合が高くなります。
無菌性検定と同時に発芽促進処理をかけることもできます。促進とはいっても主な目的は発芽時期を揃えることで、無菌系ではホルモン処理を行います。なお、アカマツやクロマツは光発芽種子なので光も当てるようにします。連続光より昼夜があった方がよいので、可能ならそうします。机の上に置くというのもチェックしやすいので悪くはないでしょう。その場合当然しっかりシールします。ただし酸欠になるとあっさり死ぬことがあるので、シールする場合は種子の数を控えめに。19個蒔きならたぶん大丈夫(近年さっぱり無菌系やってないので勘が鈍ってます)。シールをしない場合も、ガラスシャーレはプラスチックシャーレに比べ換気が悪いので、たくさん播種するときは要注意です。
ホルモン処理にはジベレリンを用います。私は入手しやすいGA3を使っています。10-20μM程度で用いるものだそうで、分子量が300くらいですから、5mgを1リットルに溶かせばだいたい必要濃度になります。とはいえ1リットルもできても困りますから、0.1mgが量れる天秤でなるべく少量のGA3を量り取り、それに応じて水を加減しています。やや溶けにくいので超音波をかけたり少量のエタノールやアセトンに溶かして薄めたりします。これを孔径0.45μm程度の親水性メンブレンフィルターで濾過除菌して使用濃度の無菌ホルモン溶液とします。具体的には注射筒に吸い上げてから針の代わりにフィルターを取り付けてぽたぽたと出して濾過します。殺菌が終わった種子をこの溶液にしばらく漬けて、濡れた状態で無菌性検定用培地に置いてやります。培地に置いてからホルモン溶液を滴下することも。なお、このやり方は十分に最適化したものではないので、まだ改善の余地があるはずです。
ジベレリンは植物生長調節剤としても(試薬と比べれば)安価に市販されており、多分使えるはずですが、添加剤が含まれているので濾過除菌に支障があるかも知れません。その辺は試行錯誤よろしくです。
培地上に1週間も置くとそろそろ根が出はじめてきます。そのままにしておくと根が曲がりくねって使いにくくなってしまいますから、数mm以上伸びる前に早めに適当な苗床に移します。苗にまで育てず種子のまま菌根合成のための容器などに移すこともあります。苗床で根の伸び具合を観察しやすいようにするには、苗床の材料に1%くらいの薄い寒天を使います。最適濃度は寒天のメーカーによって異なります。根が見えなくていいなら、滅菌した砂その他の素材を使ってももちろん構いません。バーミキュライトを使うと根が粒子を層に垂直な方向に貫いて伸びることがあり、除去に苦労しますのであまりおすすめできません。「芝の目土」として売られているごく小粒の赤玉土が、経験上は一番扱いやすい材料です。
細かいことを言えば、根は種子の尖った部分から出るので、そこを下にして培地に挿すようにするとまっすぐ伸びた苗が得られます。また、培地に入り損ねた根が表面をのたくるようなこともありません。数が多いとやってられませんけれど。
苗床にはそう長い期間おくわけでもないので、容器としてはマヨネーズ瓶などが使えます。コニカルビーカーにアルミ箔の蓋でもいいですし、試験管をたくさん使う方法もあります。組織培養用フラスコでは口が小さすぎて作業が困難でしたが、ボトルシップを作れるような器用な人なら問題ないかもしれません。試験管をたくさん使う場合は、採血用の短いものが適しています。1本につき2個か3個程度の種子を入れます。試験管を使う場合はもしコンタミが出てもその試験管以上に被害が広がりませんから、無菌性検定を省略することも可能なはずです―やったことはありませんが。やるなら素寒天ではなく多少栄養の入った培地が必要です。
腰高シャーレに湿った芝の目土を入れて滅菌したものに催芽(発芽処理)種子を置くのが今のところ一番やりやすい方法です。丸ごと冷蔵庫に入れて発芽を遅らせることである程度発芽時期のコントロールができますが、ばらつきが出るのは仕方ありません。
植物と菌根菌だけの系での接種、菌根合成について。「無菌系」と言うこともありますが、菌根「菌」はいるのですから、その言い方はちょっと変ですね。
# こーゆー実験の方法について、M大学のM先生に森林学会で何度も「前世紀的」っていわれちゃった、しゅーん。とか言ってみる。
普通は純粋培養した菌糸体を使います。時には汚染のないよう注意して得た胞子を用いる場合もあります。胞子紋をとるようにして直接無菌の根に胞子を落としてやることも。あまり胞子が飛ばないからとしばらく置いておいたらキノコバエの幼虫が培地を這ってたなんてこともありました。案外コンタミしないんですよね、それでも。まあ気持ち悪いのでそういうのは使いませんが。
分離や培養については別項に書きましたが、そのようにして得た菌株の旺盛に生育している部分を用います。常識的には寒天培地からコルクボーラーで抜いたディスクを使います。ろ紙に液体培地をしみこませてその上で菌を育てておいた菌糸シートイノキュラムを使ってもいいでしょう。糖分の持ち込みを避けるなら菌糸シートイノキュラムを殺菌水ですすいで使います。どんなイノキュラム形態が適切かは菌の生理的特性に依存します。
雑菌の侵入を防ぐため、根系または植物体全体を容器に密封します。いろいろな容器が考案されており、Methods in Microbiology volume23 (Norris, Read and Varma, Academic Press, 1991)などに記述されています。軟式のもの(growth pouch)も用いられますが、私は専ら硬式のもの(袋ではなく箱ということ)を使っています。
基本的には、信州大学の山田明義先生が日菌報に書かれた記事とかMycorrhizaに載った論文とかを参照してください。そのうち私なりの解釈で書いてみますが、所詮二次情報ですから…。
上記奈良教育大学の菊地さんに教わった方法を一部改変したものです。地上部を外に出すことと、透明な蓋を通して連続的な観察が可能なことが特徴です。上の本にたくさん書かれているもののひとつ、Wang の方法に比較的近いでしょう。
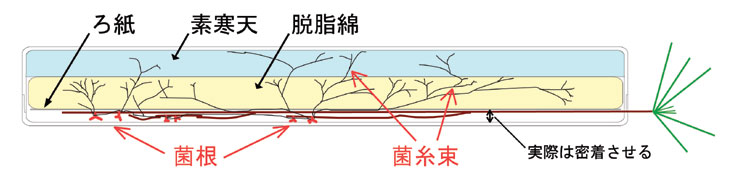
サンプラテックのスチロール角形ケースNo.4を基本にしています。地上部を外に出すための加工として、蓋の縁に深い切り込みを入れます。身の方も対応する位置を浅く削ります。図では説明の都合上根が蓋から離れていますが、実際は密着させますので、その分蓋の縁はぎりぎりまで削る必要があります。具体的には細いドリルで苗を通す位置に穴を開けてから、きわめて目の細かいノコギリで縁から切り込みを入れるようにしています。工具の詳細はtipsのページの当該項目へ。
次に、遮光のため側面を黒く塗ります。その前に、ケースの製造時に付着した離型剤と切削作業中に出た削りかすの除去のため、柔らかいスポンジを用いて洗剤と温水で洗浄します。塗料としてはラッカー系のもので、プラスチックに使えるタイプが一番間違いありません。プラモ用のものがぴったりです。マスキングしてスプレーで塗ってもいいのですが、蓋と身のかみ合わせと切り欠きの部分の処理が難しいので、筆で塗った方が早いかもしれません。どうしても塗りむらが生じて結構光が透けるので、少なくとも二度塗りは必要です。このステップを省略してアルミホイルで包む方法もあり、遮光はむしろそちらの方が完全ですが、観察時にいちいち剥がして巻いてでは数が多い場合には手間がかかりすぎると思います。
加工を施したケースは殺菌しなければいけません。しかしスチロールは70℃くらいで軟化してしまうので、オートクレーブは使えません。エチレンオキサイドガスも今は実験室レベルでは使えないので、過酸化水素を使います。これの利点は強力な酸化剤である上に蒸発して跡を残さないこと、分解産物が無害なことです。さらし粉など不揮発性の薬品と違い、消毒のあと殺菌水ですすぐ手間が要りません。理屈の上ではきれいに洗って殺菌灯を当てればそれなりに無菌になりそうなものですが、試しにクリーンベンチで殺菌灯を一晩当てたらスチロールが飴色になってしまいました。ぎゃぼー。
 左半分が変色したスチロールケース
左半分が変色したスチロールケース
過酸化水素はスプレーして殺菌します。30%過酸化水素は、ほんのわずかでも手につくと少し間をおいて皮膚が白くなって激痛が走るという劇薬(経験者は語る―酸素の泡なのでしばらく耐えれば跡も残さずきれいに消えますが、何十年かしてガンになるかどうかはまだ分かりません(^^;がとりあえず30年無事でいます)なので、作業には保護眼鏡(普段の眼鏡でOK、クリーンベンチが安全キャビネットタイプなら不要)、マスク(ガーゼで充分)、ゴム手袋、白衣程度は必要です。ゴム手袋は使い捨て極薄タイプがよいでしょう。過酸化水素は普通は圧力逃がし弁付きの瓶に入っているはずですが、密封すると破裂の恐れがあって危険なのは常識ですね(塩化鉄運んだタンク車でそのまま過酸化水素を運んで首都高の上で大爆発、なんて事件もありました)。
30%の過酸化水素水原液だけでは、離型剤が除去してあってもケース表面の濡れ性に問題があるので、噴霧してもうまく殺菌できません。そのため展着剤兼用の純エタノールと1:1に混合したものを用います。これでも完全には濡れませんが、ケース内側にできるだけまんべんなく吹き付けます。中に溜まるほどたくさん吹き付ける必要はありません。ていうか溜まっても無駄で邪魔なので捨てましょう。捨てる先は次に滅菌する容器にすれば無駄にならないかも。
なお、言うまでもありませんがこの混合液は大変危険な「毒の霧」です(もちろん緑色ではありません)から、十分な防護措置を採らなければなりません。本来ドラフトでやるべき(クリーンベンチでなければならないことはない)作業ですが、実験室を閉め切って実験台の上にケースを並べて一気に吹き付けてしまうという、いささか(じゃないだろオイ)危ない方法でやったこともありますが(あぶねえ学生だな)、無茶はやめましょう。噴霧作業中はもちろん火気厳禁です。可燃物(スチロール)に対し可燃物(エタノール)に薄いとはいえ酸化剤(過酸化水素)混ぜたものをかけるとか、ねえ。
100個以上とか数が多い場合は、吹き付けたらすぐにケースの蓋を閉め、段ボール箱に入れます。このとき切り欠きが箱の奥の方を向くように。段ボール箱には、底の継ぎ目から外気が入るのを防ぐため、箱より一回り大きい紙(新聞紙など)をあらかじめ底に入れて、同じ消毒剤を噴霧しておきます。
段ボール箱にケースを納めたら箱を閉じて送風乾燥機に入れ、60℃程度でなるべく弱く風を送りながら数日間かけてゆっくり殺菌しつつ過酸化水素を揮発させます。何だか酢臭いような、エステル臭いような変な匂いがしますので換気を十分に。段ボールを用いるのは、もちろん箱を通して消毒剤を揮散させるためです。プラスチックコンテナなどを使うと通気が悪いため、その分余計に時間がかかります。だからといってコンテナ内部に風を通すと汚染のおそれがあります。万一温度がスチロールの軟化点に達してしまうとえらいことになりますから、絶対に65℃を超えないように注意します。温度の均一化という点でも送風乾燥機は有効です。
2-3日して消毒剤が揮散しきった頃を見計らって、箱ごと速やかにクリーンベンチに持ち込みます。のんびりしていると箱が冷めて内部の空気が収縮し、外から雑菌を含んだ空気を吸い込んでしまいます。きのこ栽培で言うところの「戻り空気による汚染」です。クリーンベンチ内で中身の乾き具合をチェックして、もしも消毒剤が残っているケースがあったら蓋を開けて乾かします。乾いていないケースが多いようなら乾燥機に逆戻り。この処理でほぼ完全に無菌にできますが、切り欠きに伴う開口部があるので無菌のまま維持することはできません。そのため殺菌後は速攻で使う必要があるので、がんばって無菌苗の生長とケースの乾燥終了をきっちり同期させる必要があります。無菌苗を2-3ロット時間差で作っておいてケースの準備ができたときにステージの合っていたものを使用するという手もあります。
数が少なくてクリーンベンチに余裕がある場合は、スプレーしたあとクリーンベンチに持ち込んで、身と蓋のそれぞれについて余分な液を振り切って、そのまま乾かすこともできます。振り切るだけではなく薬局で売っている滅菌ガーゼで拭き取るようにすると、わりとすぐ乾きます。数十個ならこっちの方が現実的ですね。
ケースの中身はどのような実験を行うかによって異なります。上の図に示したのは単純に菌根を合成するための装置で、ケースの身の部分に栄養分を含まない素寒天を50-80mlくらい(もちろんケースサイズに依存)入れて、その上にクッションとなる脱脂綿を入れます。カット綿を使ってもいいですし、自分で裁断機で切ってもいいでしょう。ふつう脱脂綿はシート状になっているので、崩さないように広げて適当なサイズに切ります。はさみで切ることもできます。裁断機というのは、事務用品のあれです。レバーで刃を押し下げて紙を切る道具。ちょっとこつがいります。上からもしっかり押さえて固定して切ること。事務のお姉さんと仲良くなっておいて事務室の電動式のを使わせてもらうとすごく能率よく作業できます。脱脂綿は水に浸して軽く絞ると驚くほど体積が小さくなりますが、必ずしも絞ってつぶした状態で使うことはなく、ピンセットで引っ張って空気を含ませても問題ありません。でもケチらない方がいいですね。短期なら寒天も脱脂綿も使わず湿ったバーミキュライトだけを詰めたこともあります。
脱脂綿の適量は、全体に水がなじんだら軽く押さえるとケースの蓋が閉まって手を離しても開かない程度。市販脱脂綿を自分で適当なサイズに裁断する場合、だいたい3g程度にしています。が、これはロット依存なのでテストをして決める必要があります。少なすぎるとろ紙の上の根が蓋に密着しませんし、うまく水が移動しません。水の量も重要で、蓋を閉めるときにあふれるのは論外、端をつまんで斜めに持ち上げると滴ったりするようでは多すぎです。テストでパラメータを決めてください。一応寒天が50mlの時は水はそれよりやや少ないくらいを目安にしています。かなりびちょびちょです。もっと減らしてもよいでしょう。寒天80mlに水20mlでやることもあります。脱脂綿の品質などに依存しますので、テストテスト。あと、なるべく上等な脱脂綿をお勧めします。安物は繊維が短くてリント(綿くず)だらけになるわちぎれやすいわ、ひどいのになると水を吸いにくいわ、いいことありません。
無菌の脱脂綿をピンセットで必要量ケースに詰めるのは、事前に必要なサイズに裁断してあっても少々手間です。ていうか、裁断済みでないと無理。医療用の滅菌済み綿球もいいかも知れません(コストがかかりそうですが)。寒天を増やすと作りやすいですが、特に夏場は寒天が固まるまでに余計に時間がかかります。季節を問わず、作業中に待ち時間が発生してしまうときは、ケースに流し込む寒天が固まってしまわないようにホットプレートやウォーターバスで溶けた寒天を保温したり、分注器を使うならバルブ内部で固まらないよう時々ピストンを動かしてやるなどの対応が必要になります。寒天をいくつかに分けてオートクレーブにかけて、余熱で熱いオートクレーブの中に置いておいて順次取り出すという手もあります。
固まった寒天の上に脱脂綿などを詰めたら、仕上げに角形ろ紙をケース内寸に合わせて切ってオートクレーブしたものを一番上に乗せます(って料理かい)。最初に裁断した脱脂綿とろ紙とをミルフイユ状態で滅菌缶(クッキーの缶でもいいですが―戻り空気による汚染に注意)に入れてオートクレーブしておいて、一組ずつケースに入れてそっと規定量の滅菌水をかけるという方法もあります。このケースの中身自体もまだまだ改善の余地が大いにあるでしょう。工夫して下さい。
ケースの内容物を詰めたら、苗床の無菌容器から無菌苗を取り出して植え付けます。適期は直根が5-8cmくらいになった頃から側根が出始めた頃までです。植え付けるときにどうしても多少根が傷みますが、根端が傷ついた場合は少し上から代替の根が発生します。場合によっては少し長く置いた無菌苗を根切りして用いてもいいでしょう。また、若い芽生えの軸は脆弱なので、苗床から取り出すのに使うピンセットの火炎滅菌後の冷却が不十分だと火傷でだめにしたり、単純に力を入れすぎてつまみ潰したりすることがあり、慎重な操作が必要です。火傷防止には、殺菌水のビーカーを用意しておいて、焼いたピンセットは都度そこで冷ますのが効果的です。ただしそれが汚染源になると最悪なので絶対にコンタミさせないように。複数のビーカーを用意して取り替えていけば、万一作業中に汚染してもそのあとの全部がやられることは防げます。
取り出した苗をろ紙の上に置き、地上部を切り欠きから外に出します。蓋をして、軽く押さえて根とろ紙を蓋に密着させます。うまくいかないときは苗を蓋に置いて濡れたろ紙をかけてから身と合わせます。接種を行うのは苗をろ紙に置く段階でです。培養した菌糸体や寒天片などを根の周囲に適宜置いてやります。これから発生する新根と接触するように配置するのがポイント。
蓋をしたら、周囲を粘着テープで封じて乾燥やコンタミを避けます。プラスチックでできた絶縁テープが適度な伸縮性もあって適しています。とはいえ伸縮性があるからといって強くテンションをかけて貼ると、時間とともにずれてしまいます。あまり引っ張らずに貼りましょう。ビニールの絶縁テープもまあいいのですが、伸縮性がありすぎて時間が経つとずれやすい上に跡に糊が残ってずるずるになりやすいのでいまひとつ。セロハンテープは水に弱いので向きません。プラスチックと合成樹脂系粘着材を使ったテープなら使えます。
次に切り欠き部分の隙間をラノリン(やワセリン)で封じます。ラノリンはるつぼや小さなビーカーに入れてガスバーナーであぶり、全体に溶けて透明な液体になるまで加熱してから使います。この段階で充分に滅菌されるはずですが、気になるなら事前にオートクレーブしてもいいでしょう。作業中に固まってきますから、ミクロスパーテルを軽くあぶってすくい取り、温度が下がって粘性が上がってきたタイミングで切り欠き部分に塗りつけます。高温すぎてさらさらの液体では流れてしまいますし、苗を傷めます。低温過ぎてもうまく付きませんが、ちょっとぼってり付いてしまったものを後から熱いミクロスパーテルで整形するのは簡単なので、固まりかけくらいの温度でやってもいいでしょう。苗の周囲を封じたら、今度は少し温度が高いものを使って流すようにして蓋の切り欠きの縁をしっかり封じます。いずれにしろ本番前にちょっと練習した方がいいでしょう。
試しに一般機械潤滑用のグリスを使ってみたら、案外いけます。オートクレーブして冷まして塗るだけ。加熱しないでも扱いやすい固さなので、もしかしたらラノリンよりこちらの方が優れているかも知れません。あと安いし。
完成した接種装置は上下逆さまに、つまり蓋を下にして積み重ねます。こうすれば重力屈性により根が蓋に沿って伸びます。蓋を上にして置くと、あっという間に根がろ紙を突き破って寒天まで潜り込んでしまいます。本来横向きではなく地上部を上にするのがよいのでしょうが、脱脂綿に含まれた水が重力で下に移動してしみ出してコンタミの原因となります。水の量を加減するなどしてその問題に対応するなら、立てて置いても構いません。その場合、蓋から光が入らないようにアルミ箔や板などで遮光する必要があります。もちろん横置きでも上下の遮光は必要です。ある程度傾けたスタンドを作ってその上に置くというのもよいでしょう。接種直後は馴化のため高湿度弱光の環境に数日間おきますが、苗の状態によっては省略可能なこともあります。
水平に置くにしろ傾斜または垂直に置くにしろ、十分な照明が必要です。そのために組織培養用照明棚(ライトバンク)を使えるならもちろんそれで構いませんが、明るさが足りるかどうか気をつけた方がよいでしょう。照明棚は高価ですが、手作りすることもできます。市販のメッシュラックかアングル棚にトラフ型の蛍光灯器具を取り付けるだけです。室内灯によく用いられている40W型直管蛍光灯器具は長さが約1.2m強なので、1200mm幅の棚を組めば僅かにはみ出す程度で収まります。私は棚の奥の面に蛍光灯を横向きに二段に設置して、その手前に接種装置を置いてやりました。上段の棚板の下に設置して上から照らすこともできますが、蛍光灯とはいえ結構な発熱量があるので上段の温度には注意すべきです。効率改善のためには蛍光管に取り付ける反射板が有効です。はっきり分かるくらい明るくなりました。なお、蛍光灯器具の説明書には電気工事士の資格が必要と書いてありますが、普通この種の器具は天井などに電気工事を行って設置するものであり、その場合には当然資格が必要になるということです。
蛍光灯にも種類があり、器具との対応が問題になります。安くすませるならグロー管式(スタータ式と呼ばれます)の蛍光灯器具とそれ用の白色灯。植物育成用の特殊蛍光管もあり、私が知っているものにはNECのビオルックスA, HGや、パナソニックの植物用蛍光灯があります。この手の実験でメタハラまで使うことはないでしょう。メタハラとはメタルハライドランプのことで、HIDの一種です。ていうか、水銀灯。
基本的に二者培養系での作業と同じです。無菌性に気を遣う必要がないのでたいへん気が楽です。一部違う点もありますので、そこについて。
消毒したマツの種子を発芽させます。無菌にする必要はありませんが、無菌根を維持する必要があるので、それなりの工夫が必要です。
開放系では無菌性検定は不要ですが、発芽を揃えるための促進処理は行った方が斉一な実生が得られます。無菌系と同様にホルモン処理を行うこともできますが、開放系ならではの方法として物理的に殻割りを行うこともできます。その方法は、十分吸水した種子の尖った部分を両脇からピンセットか爪の先で軽くつまんで「プチッ」と割るというものです。種子は全体にやや扁平で、尖った部分には側面に稜線がありますが、発芽時にはこの線から割れます。そのため、稜線上を爪でつまんで、内部の幼根を傷つけないようにそっと力をかけて割って吸水と幼根の伸長を助けてやります。
 クロマツ種子をピンセットでつまんだところ、この稜線部を軽くつまんで割ってやる
クロマツ種子をピンセットでつまんだところ、この稜線部を軽くつまんで割ってやる
接種まではバーミキュライトや砂などの素材で育成します。開放系とはいえ目的外の菌根菌の混入を防ぐため、清潔な材料をいったんオートクレーブして使うようにします。これには材料を水になじませるという意味もあります。あまりきれいでない、有機物が混ざっているようなものを使うと、オートクレーブ後に微生物的空き家になってトリコデルマやペニシリウムが大繁殖したりするおそれがあります。変なものが煮えていやーな臭いがしていたり。ただ、アカマツ林のB層土壌ならオートクレーブして使っても問題ないという話も聞きました。
育成期間はおおむね子葉が開ききってから初生葉が伸び始める程度まで。子葉が開きはじめるとついついその先に付いている種子の殻を取ってしまいたくなりますが(ならない?)、これは取ってはいけません。この段階ではまだ中に胚乳が残っていて、取ってしまうと初期生長に響きます。よく分かりませんが子葉の先端から養分を吸収しているように見えます。たまにうまく脱落しないで子葉の先がちぎれたりするものがないこともない(たぶん1%以下)ですが、余計なことをせず自然に開くのを待ちます。子葉が開いたらもう取っても大丈夫です。
ここまで来れば一応接種可能です。もちろんさらにしばらく置いて大きくしても構いません。軸が木化するまで待った方が扱いは容易になります。十分な肥料と水を与えればそのまま無菌根でも生育は可能です。実験室内なら(きのこを持ち込んだりしない限り)菌根のコンタミもまずありません。
無菌系で用いたような接種観察容器を利用することももちろん可能です。しかし開放系ではトリコデルマやペニシリウムが侵入してわけの分からないことになる恐れがあります。このような場合、例えばショウロ・クロマツ系では水の代わりにベノミル0.01%水溶液を用いると雑菌をいくらか抑えることができます。接種観察容器内の脱脂綿を湿らせる水に添加します。別項にも書きましたが抗菌剤への感受性は菌の種類によって異なるので予備試験が必要ですし、この手が使えない菌もあるでしょう。
ショウロでやっている方法で、むかしこれで特許というものを取ってみたりしましたが今は失効しています。
初期には下記のように凝固剤として希塩酸を使っていましたが、最近は1%塩化カルシウム水溶液で充分であることに気がつき、これなら浸透圧による害もないので、すっかり鞍替えしました。以下の記述は希塩酸を1%塩化カルシウム水溶液に読み替えて下さい(2020.08追記)。
成熟したきのこをミキサーにかけて濃厚胞子懸濁液を得ます。具体的なことは菌根性きのこのいくつかについてにも少し書きました。そうやって得た胞子液を適当に薄めて、増粘・ゲル化剤としてアルギン酸ナトリウムを1%加えます。完熟ショウロで作った場合10倍希釈なら確実、30倍でもまず大丈夫でした。ただしこれは原液の品質に影響されます。ここに上記のようにして育てた苗の根を浸して、引き上げると根に胞子ゾルが絡みますからこれを0.1Nくらいの希塩酸にディップして固定します。2%乳酸カルシウムとか0.4N塩化カルシウムとかでも固まるそうですが、胞子はともかく根は脆弱なのであんまり薬品にさらしたくないため、一瞬で固まる塩酸を使っています。作業効率もいいですし。小さな苗ならだいたい1本あたり1グラム前後消費するはずです。10倍希釈の濃厚ゾルを使っても、100本接種するのに胞子原液10g、1:1加水でミキサーにかけたのなら成熟ショウロ5g、ということは2-3個程度必要です。でもこれよりだいぶ(何桁か)薄くてもだいたいうまくいきます。なお、このゲルはすぐに生分解されます。
バリエーションとして、胞子を含むアルギン酸ナトリウムゾルを希塩酸に滴下してゲルにしてから苗の根に与える方法もあります。滴下するときそっとぽたぽた垂らすと何やらタピオカパールのような、濃度によっては赤血球のような形のつぶつぶになるので、すくって用います。胞子の量をきっちり決めたいときにはこの方法を用い、ピペットで一定量吸い上げたゾルをゲル化して与える方がいいでしょう。でもピペット内壁に粘り着くのであんまり正確にはなりません。気に入らないなら希塩酸の入ったビーカーを電子天秤に載せて滴下量を測定し、少しも残さずすくい取ってはゼロ点をあわせ直して次を滴下。
根に胞子ゲルを付けた苗は、そのまま菌根菌を含まない培土で鉢植えしてしばらく育てます。もちろん透明ケースで観察することもできます。植えてから早ければ3週間、遅くても1ヶ月半くらいで菌根ができてきます。ショウロは菌根を作るとすぐに菌糸束を伸ばして周囲に蔓延しようとします。ヤマドリタケモドキもクヌギの根の上で似たような振る舞いを示しました。
(この項未完)